چکیده
زینترینگ دولومیت خام و هیدروکسیدهای مشتق شده از دولومیت در محدوده دمایی ۱۳۵۰–۱۶۵۰ درجه سانتیگراد انجام شد. هیدروکسید مشتق شده از دولومیت از طریق پیش کلسیناسیون دولومیت و به دنبال آن هیدراسیون آن توسعه یافت. برای توسعه هیدروکسید، پس از پیش کلسیناسیون، یک نمونه در هوا کوئنچ شد و پودر دیگر قبل از آبدارسازی در کوره سرد شد.
نمونههای کوئنچ شده در هوا، تراکمپذیری بهتری را نسبت به فرایند سردکردن در کوره در همان دما نشان دادند. افزودن Fe₂O₃ زینترینگ را از طریق تشکیل فاز مایع در دمای بالاتر افزایش میدهد. اندازه دانه دولوما (doloma) با افزودن Fe₂O₃ بزرگتر از نمونه بدون افزودنی است. مقاومت به آبخوردگی به تراکمپذیری و اندازه دانه دولومیت زینتر شده مرتبط بود.
کلمات کلیدی:
زینترینگ؛ ریزساختار؛ مقاومت به آبخوردگی؛ دولوما
- مقدمه
دولومیت یک ماده دیرگدازی پایه با ترکیب ایدئال [MgCa(CO₃) ₂] است. دولوما (MgO-CaO) تولید شده از دولومیت، شامل مخلوط فازی آهک (lime) و پریکلاز (periclase) است. این مواد دارای نقطه ذوب بسیار بالا با دمای یوتکتیک ۲۳۷۰ درجه سانتیگراد هستند. مقادیر مختلفی از ناخالصیها شامل SiO₂، Al₂O₃ و Fe₂O₃ در دولومیت وجود دارد [۱,۲]. مقدار و نوع این ناخالصیها ممکن است تأثیر زیادی بر میزان تراکمپذیری داشته باشند. دولومیت به طور سنتی بهعنوان ماده فتلینگ (fettling) برای کف کورهها (مبدل بسمر) استفاده میشد [۳]. آبخوردگی دیرگداز دولومیتی به دلیل وجود فاز CaO یک مشکل عمده است. برای بهحداقلرساندن این مشکل، درگذشته دولومای تثبیتشده (stabilized doloma) با واکنش دولومیت با مواد سیلیسی یا اکسید آهن تولید میشد [۴]. زینترینگ امکان تشکیل فازهایی مانند دیکلسیم فریت (dicalcium ferrite)، تتراکلسیم آلومینوفریت (tetracalcium aluminoferrite) را فراهم میکند که ریزساختار را در برابر آبخوردگی تثبیت میکنند.
پس از معرفی کوره اکسیژن پایه (BOF)، توجه بیشتری به توسعه دولومای باکیفیت بهتر، بسیار متراکم و مقاوم در برابر خوردگی معطوف شد. توسعه ذرات بسیار متراکم و جمعشده (shrunk) خوب نهتنها برای مقاومت در برابر آبخوردگی، بلکه برای جلوگیری از نفوذ سرباره به داخل ماده ضروری است [۵,۶]. در ابتدا در BOF، از دیرگدازهای دولومیتی/منیزیایی پیوندیافته با قیر/تار (pitch/tar bonded) استفاده میشد [۷]. با توسعه دیرگداز MgO–C، کنورتورهای BOF تنها با این دیرگداز آستر میشوند. امروزه در سراسر جهان، فرایند دیکربوریزاسیون اکسیژن - آرگون (AOD) روش استاندارد برای تولید فولاد زنگنزن با مسیر EAF–AOD بهعنوان رایجترین روش است [۸,۹]. در اینجا فرایند اولیه شامل دمش اولیه اکسیژن برای اکسیداسیون کربن فولاد و به دنبال آن دمش گاز بیاثر برای بازگرداندن اجزای اکسید شده مانند Ni و Mo به حمام است. شرایط کنورتورهای AOD شامل دمای بالای ۱۷۰۰ درجه سانتیگراد، تلاطم فلز مایع و گاز و خوردگی سرباره باخاصیت بازی و قلیایی (basicity) ۱.۵–۲.۰ است. دولومیت مادهای ترمودینامیکی پایدار در محیط فولادسازی است. به دلیل ماهیت شیمیایی آن، دولومیت تحتتأثیر شرایط کاهنده ایجاد شده در طول فرایند تولید فولاد زنگنزن قرار نمیگیرد.
قوش و همکاران نشان میدهند [۱۰] که وقتی ماده اولیه در محدوده زیرمیکرون (۰.۵ میکرومتر) باشد، دولومیت ممکن است با تکنیک تکپخت (single firing) در ۱۶۵۰ درجه سانتیگراد متراکم شود. اندازه کریستال CaO و MgO در دولوما توسط دما و محتوای ناخالصیها کنترل میشود [۱۱]. افزایش این ناخالصیها اندازه کریستالیت (crystallite) را افزایش میدهد. وونگ و برادت [۱۲] مشاهده کردند که وقتی دولومیت به شکل کربنات اصلی زینتر میشود، یک ریزساختار خوشهای درهم نفوذی (interpenetrating cluster) کلاسیک رخ میدهد. در طول...
۲. روش آزمایشی
۲.۱. آمادهسازی و مشخصهیابی پیشمادهها
ماده اولیه مورداستفاده در این تحقیق، یک دولومیت طبیعی از جبالپور هند بود. دولومیت خام خرد شد تا اندازه مش ۳۰۰- BS به دست آید. ترکیب شیمیایی دولومیت با روش شیمیاییتر استاندارد تعیین شد. دو پیشماده هیدروکسیدی به دو روش مختلف با پیش کلسیناسیون (precalcination) به دنبال آبدارسازی (hydration) تهیه شدند. در حالت اول، دولومیت در دمای ۱۰۰۰ درجه سانتیگراد به مدت ۲ ساعت کلسینه شد، در داخل کوره سرد شد، در دمای اتاق از کوره خارج شد و آب به آن اضافه شد. این هیدروکسید بهعنوان "F" نامگذاری شد. در حالت دوم، نمونه پس از کلسیناسیون در دمای بالا از کوره خارج شد و مستقیماً در هوای جاری کوئنچ شد و به دنبال آن آبدارسازی انجام شد. این نمونه بهعنوان "A" نامگذاری شد.
۲.۲. زینترینگ
کربنات دولومیت (DS) (مش BS ≤300) با محلول 5 درصد وزنی PVA مخلوط شد و پودرهای هیدروکسید ('A' و 'F') با 5 درصد وزنی آب به عنوان چسب مخلوط شدند و تمام نمونهها به صورت تک محوری با فشار 140 مگاپاسکال به بریکت تبدیل شدند. بریکتها پس از خشک شدن در دمای 110 درجه سانتیگراد به مدت 24 ساعت، بین دمای 1350 تا 1650 درجه سانتیگراد با فاصله زمانی 100 درجه سانتیگراد و 2 ساعت زمان نگهداری در دمای اوج، پخته شدند. پخت در یک کوره الکتریکی کنترل شده با برنامه انجام شد و سرعت گرمایش از 5 درجه سانتیگراد در دقیقه تا 1000 درجه سانتیگراد و به دنبال آن 3 درجه سانتیگراد در دقیقه تا حداکثر دما حفظ شد.
۲.۳. مشخصهیابی دولوما
دولوما از نظر چگالی تودهای (Bulk Density)، تخلخل ظاهری (Apparent Porosity)، مقاومت به آبخوردگی (Hydration Resistance) و تکامل ریزساختار (Microstructural Development) مشخصهیابی شد. چگالی تودهای و تخلخل ظاهری با روش جابهجایی مایع استاندارد در زایلن با استفاده از اصل ارشمیدس اندازهگیری شد. برای اندازهگیری مقاومت به آبخوردگی، دولوما خرد و آسیاب شد تا از الک مش ۵ BS عبور کند. ۵۰ گرم از دولومای مش ۱۰+۵- BS بهدقت توزین شده و در پتری دیش شیشهای قرار داده شد و به مدت ۳ ساعت در کابین رطوبت بخار در دمای ۵۰ درجه سانتیگراد و رطوبت نسبی ۹۵٪ تحت آبخوردگی قرار گرفت. پس از آزمایش، درصد افزایش وزن اندازهگیری شد. مشخصهیابی ریزساختار توسط میکروسکوپ الکترونی روبشی (SEM) انجام شد. از نمونههای زینتر شده و صیقل داده شده اچ حرارتی شده (Thermally Etched) با پوشش طلا استفاده شد.
۳. نتایج و بحث
ترکیب شیمیایی دولومیت طبیعی انتخاب شده برای مطالعه در جدول ۱ نشاندادهشده است. نتایج نشان میدهد که دولومیت نسبتاً خالص با محتوای ناخالصی حدود ۲٪ وزنی است.
۳.۱. تراکمپذیری (Densification)
رفتار زینترینگ دولومیت خام و هیدروکسیدهای مشتق شده از دولومیت بامطالعه دیلاتومتری (Dilatometric) انجام شد (شکل ۱). نشان میدهد که نمونه کربناتی (DS) ویژگیهای زینترینگ ضعیفی دارد. جمعشدگی (Shrinkage) از ۱۰۰۰ درجه سانتیگراد شروع میشود و نرخ آن تا ۱۲۰۰ درجه سانتیگراد کند است. برای نمونههای هیدروکسیدی، جمعشدگی پس از تجزیه هیدروکسید از ۶۰۰ درجه سانتیگراد شروع میشود و جمعشدگی قابلتوجهی تا ۱۱۰۰ درجه سانتیگراد رخ میدهد. جمعشدگی نمونه "A" در مقایسه با نمونه "F" بیشتر است. سطح ویژه (Specific Surface Area) اکسیدهای مشتق شده از کربنات (DS) و هیدروکسیدها (F و A) در جدول ۲ نشاندادهشده است. نشان میدهد که اکسید حاصل از تجزیه کربنات اصلی در ۱۰۰۰ درجه سانتیگراد دارای سطح ویژه کمتری (۱ m²/g) است. درحالیکه اکسید مشتق شده از هیدروکسیدها (F و A) در ۶۰۰ درجه سانتیگراد سطح ویژه بسیار بالاتری (۳۰–۲۵ m²/g) نشان میدهد که به فرایند زینترینگ کمک میکند. این اکسیدهای زودهنگام متولد شده از هیدروکسیدها تحت جریان پلاستیک (Plastic Flow) [۱۶] قرار میگیرند و زینترپذیری (Sinterability) قابلتوجهی در دمای پایینتر نشان میدهند؛ بنابراین، جمعشدگی ناشی از زینترینگ "F" و "A" بسیار بیشتر از DS است.
تراکمپذیری دولومیت خام (DS) و هیدروکسیدهای مشتق شده از دولومیت (F و A) در شکل ۲ نشاندادهشده است. مشاهده میشود که چگالی تودهای DS بسیار کمتر از F و A است. چگالی تودهای همه نمونهها با افزایش دمای زینترینگ تا ۱۴۵۰ درجه سانتیگراد افزایش مییابد. گزارش شده است که نرخ زینترینگ هیدروکسید در ۸۷۰ درجه سانتیگراد معادل کربنات در ۱۴۰۰ درجه سانتیگراد است [۱۵]. علاوه بر این، بخار آب متصاعد شده از هیدروکسیدها با کاهش زاویه دووجهی (Dihedral Angle) بین دانههای اکسید و تخلخلها، زینترینگ را افزایش میدهد [].۱۷
جدول ۱: ترکیب شیمیایی دولومیت خام
|
ترکیبات شیمیایی |
% وزنی |
|
SiO₂ |
۱.۷۰ |
|
Al₂O₃ |
۰.۱۳ |
|
Fe₂O₃ |
۰.۲۷ |
|
Na₂O |
۰.۷۲ |
|
CaO |
۵۹.۰۷ |
|
MgO |
۳۸.۱۱ |
شکل ۱: مطالعه دیلاتومتری نمونههای کربناتی (DS) و هیدروکسیدی A و F
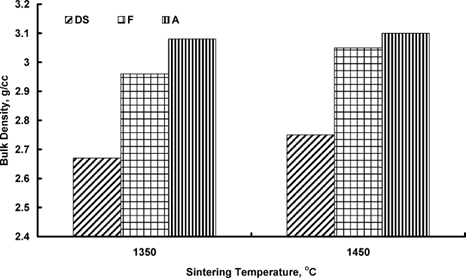
چگالی ظاهری دولومای حاصل از کربنات (DS) و هیدروکسیدها (A و F) به همراه دمای پخت.
نمونه هیدروکسیدی (A) بهدستآمده از طریق فرایند کوئنچ در هوا، تراکمپذیری بهتری در ۱۴۵۰ درجه سانتیگراد نشان میدهد. اکسیدهای تولید شده از "A" سطح ویژه بالاتری نسبت به اکسید تولید شده از نمونه کورهسرد "F" دارند. نمونه کوئنچ شده در هوا "A" در زمان خارجشدن از کوره پس از کلسیناسیون، شوک حرارتی (Thermal Shock) را تجربه میکند که نقصهایی (Defects) در شبکه اکسید ایجاد میکند. این امر انتقال ماده را با تسریع نرخ نفوذ (Diffusion Rate) دانه تسهیل میکند [۱۸]. اکسید تجزیهشده هنگام کورهسرد شدن "F" نسبتاً درشتتر (Coarser) بود که سطح ویژه پایینتری را نشان میدهد و منجر به تراکمپذیری کمتر میشود.
افزودنیها نقش مهمی در زینترینگ یک محصول دارند. Fe₂O₃ یک افزودنی مهم در تراکمپذیری دولومیت است. در فرایند دومرحلهای، نمونههای کوئنچ شده در هوا نتایج بهتری نشان میدهند؛ بنابراین تأثیر Fe₂O₃ بر مطالعه تراکمپذیری با نمونه "A" انجام شد (شکل ۳). مشاهده میشود که برای نمونه بدون افزودنی، چگالی تودهای از ۳.۰۵ g/cc به ۳.۲۵ g/cc با افزایش دمای زینترینگ از ۱۳۵۰ درجه سانتیگراد به ۱۶۵۰ درجه سانتیگراد افزایش مییابد. هنگامی که Fe₂O₃ (۲٪ وزنی) اضافه میشود، چگالی در دمای ۱۴۵۰ درجه سانتیگراد به حداکثر ۳.۳۵ g/cc میرسد. Fe₂O₃ با اکسیدها واکنش داده و دیکلسیم فریت (2CaO·Fe₂O₃) را تشکیل میدهد که در ۱۴۳۶ درجه سانتیگراد ذوب میشود و در نتیجه زینترینگ فاز مایع (Liquid Phase Sintering) را ترجیح میدهد [۱۹]. درحالیکه یونهای Fe به داخل دانههای پریکلاز نفوذ کرده و محلول جامد (Solid Solution) تشکیل میدهند، ساختار کریستالی را تغییر داده و انرژی کریستال داخلی (Inner Crystal Energy) را با ایجاد ناخالصیهای نازک (Thin Inclusions) افزایش میدهند. این امر رشد دانه پریکلاز (MgO) را فراهم کرده و با افزایش توانایی تبلور مجدد (Recrystallisation Ability)، زینترینگ را تسهیل میکند [۲]. چگالی تودهای با افزایش دمای زینترینگ به ۱۶۵۰ درجه سانتیگراد به ۳.۲۰ g/cc کاهش مییابد. با افزایش دمای زینترینگ، تشکیل فاز ثانویه بیشتر میشود که چگالی تودهای دولوما را در دمای بالاتر کاهش میدهد.
جدول ۲: ویژگیهای اکسیدهای مشتق شده از کربنات (DS) و نمونههای هیدروکسیدی (A و F
|
ویژگیها |
اکسیدهای مشتق شده از |
||
|
DS |
A |
F |
|
|
سطح ویژه، m²/g |
۱ |
۳۰ |
۲۵ |
۳.۲ریزساختار
عکسهای میکروسکوپ الکترونی روبشی دولوما بهدستآمده از نمونه "A" با و بدون Fe₂O₃ زینتر شده در ۱۶۵۰ درجه سانتیگراد در شکل ۴a و b نشاندادهشده است. نمونه بدون افزودنی نشان میدهد که دانههای گردشده (Rounded Grains) تشکیل شدهاند. تماس دانه به دانه (Grain to Grain Contact) وجود دارد و درعینحال وجود تخلخلها (سیاه) نیز قابلمشاهده است. اندازه دانه بین ۱ تا ۲ میکرومتر متغیر است. در مقابل، عکس میکروسکوپی دولومای حاوی Fe₂O₃ (شکل ۴b) ریزساختار بسیار فشردهتر و اندازه دانه بزرگتری را نشان میدهد. دانههای CaO نسبتاً روشنتر و بزرگتر از دانههای MgO هستند. میانگین اندازه دانه فاز CaO 10 میکرومتر است، درحالیکه فاز MgO 5 میکرومتر است. در دولوما، ازآنجاییکه فاز CaO پیوسته (Continuous Matrix) است، انرژی فعالسازی (Activation Energy) آن کمتر از فاز MgO است که منجر بهاندازه بزرگتر دانههای CaO میشود. علاوه بر این، حضور Fe₂O₃ رشد بیشتر دانه دولوما را به دلیل زینترینگ فاز مایع افزایش میدهد.
۳.۳. مقاومت به آبخوردگی
افزایش وزن ناشی از آبخوردگی دولومیت زینتر شده نسبت به زمان و دما در شکل ۵ رسم شده است. نشان میدهد برای همه دماها، افزایش وزن با مدتزمان آزمایش افزایش مییابد. نمونه بدون افزودنی (A–OF) زینتر شده در دمای پایین، افزایش وزن قابلتوجهی را در دمای پایین به دلیل چگالی تودهای کمتر دولوما نشان میدهد. بااینحال، ازآنجاییکه تراکمپذیری دولوما با Fe₂O₃ (A–2F) در دمای پایین در حداکثر است، در برابر آبخوردگی ایمن (Immune) میشود.
این مطالعه نشان میدهد که با اندازه دانه بزرگتر، سطح مرزدانه (Grain Boundary Surface Area) کمتر خواهد بود، بنابراین نفوذ آب به حداقل میرسد و در نهایت مقاومت به آبخوردگی بهبود مییابد.
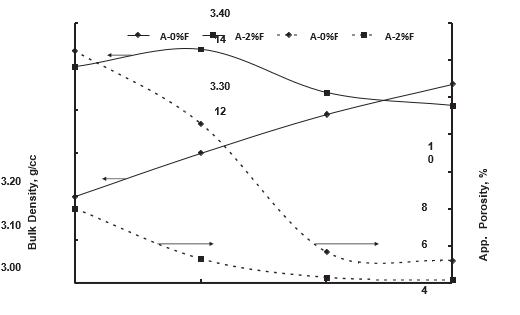
شکل 3: چگالی حجمی و تخلخل ظاهری دولومای حاصل از هیدروکسید «A» در دماهای مختلف پخت با و بدون Fe2O3.

شکل 4: تصاویر میکروسکوپ الکترونی روبشی (SEM) از دولومای بهدستآمده از هیدروکسید «A» در دمای ۱۶۵۰ درجه سانتیگراد. (الف) بدون افزودنی (ب) با ۲ درصد وزنی Fe2O3.
۴. نتیجهگیریها
دولومیت تبدیلشده به هیدروکسید آن، تراکمپذیری بهتری را نسبت به شکل کربناتی اصلی آن نشان میدهد.
برای فرایند کلسیناسیون دومرحلهای، اکسیدهای مشتق شده از هیدروکسید آن در ۶۰۰ درجه سانتیگراد اندازه ذره کوچکتری دارند که مسئول تراکمپذیری بهتر است.
نمونه هیدروکسیدی بهدستآمده توسط کوئنچ هوا، تراکمپذیری برتری را نسبت به نمونه کورهسرد نشان میدهد.
نمونه کوئنچ شده در هوا، شوک حرارتی را تجربه میکند که ذرات کوچک با ساختار معیوب (Defective Structure) ایجاد میکند و چگالی تودهای دولوما را بهبود میبخشد.
افزودن Fe₂O₃ رشد دانه هر دوفاز CaO و MgO دولوما را به طور قابلتوجهی افزایش میدهد.
با افزایش اندازه دانه، مقاومت به آبخوردگی این دولومای بسیار متراکم افزایش مییابد.
منابع
[1] M. O’Driscoll, Refractory dolomite, Ind. Miner. 6 (1998) 35–43.
[2] H. Aygul Yeprem, Effect of iron oxide addition on the hydration resistance
and bulk density of doloma, J. Eur. Ceram. Soc. 27 (2007) 1651–1655.
[3] H. Parnham, Dolomite refractories – a review of applications, Refract. J.
39 (1963) 2–12.
[4] D.F. McVittie, Advances in dolomite technology, Refract. J. 37 (January)
(1961) 2–5.
[5] D.R.F. Spencer, Development in LD refractories, Refract. J. 51 (1975) 8–
26.
[6] D.R.F. Spencer, Basic refractory raw materials, T&J. Brit. Ceram. Soc. 71
(1972) 123–134.
[7] P. Hammerschmid, E. Friedl, The properties and life of tempered tarred
dolomite bricks in LD vessel, Ber. Deusche Keram. Ges. 47 (1970) 399– 401.
[8] P. Srinivas, D.K. Singh, et al., Dolomite refractories-to continue as
undisputed leader in stainless steel and cement industry, IREFCON 2
(2000) 68–72.
[9] G. Loglmeyr, D. Romee, Upgraded dolomite brick for secondary steel
metallurgy, Interceram 40 (1980) 81–88.
[10] A. Ghosh, S.K. Das, G. Banerjee, The effect of particle size and additives
on the densification of doloma from natural dolomite, Sci. Sinter. 29
(1997) 179–187.
[11] W.C. Gilpin, D.R.F Spencer, New developments in dead-burnt dolomite
and magnesite, Refract. J. 47 (1972) 4–15.
[12] L.L. Wong, R.C. Bradt, Sintering of lime and doloma refractories with
calcium and magnesium carbonate and hydroxide additions, Am. Ceram. Soc. Bull. 69 (1990) 1184–1188.
[13] H.A. Yeprem, A quantitative-metallographic study on the sintering behaviour of dolomite, Mater. Charact. 52 (2003) 331–340.
[14] J.B. Baldo, R.C. Bradt, Grain growth of lime and periclase phase in
synthetic doloma, J. Am. Ceram. Soc. 71 (1988) 700–725.
[15] T.K. Bhattacharya, A. Ghosh, S.K. Das, Densification of reactive lime
from limestone, Ceram. Int. 27 (2001) 455–459.
[16] C.S. Morgan, L.L. Hall, Sintering of sodium chloride, J. Am. Ceram. Soc.
46 (1963) 559–560.
[17] R.L. Coble, Initial sintering of alumina and hematite, J. Am. Ceram. Soc.
41 (1958) 55–62.
[18] W.L. Dekeyser, R. Wollash, P.H. Duvigneaud, Sintering of an activated
CaO, J. Mater. Sci. 4 (1969) 989–996.
[19] A. Ghosh, T.K. Bhattacharya, B. Mukherjee, H.S. Tripathi, S.K. Das, Effect of Fe2O3 on the densification of lime, Ceramics-Silikaty 47 (2003) 70–74.

 FA
FA  EN
EN  AR
AR 